Description de la soumission d'un avis
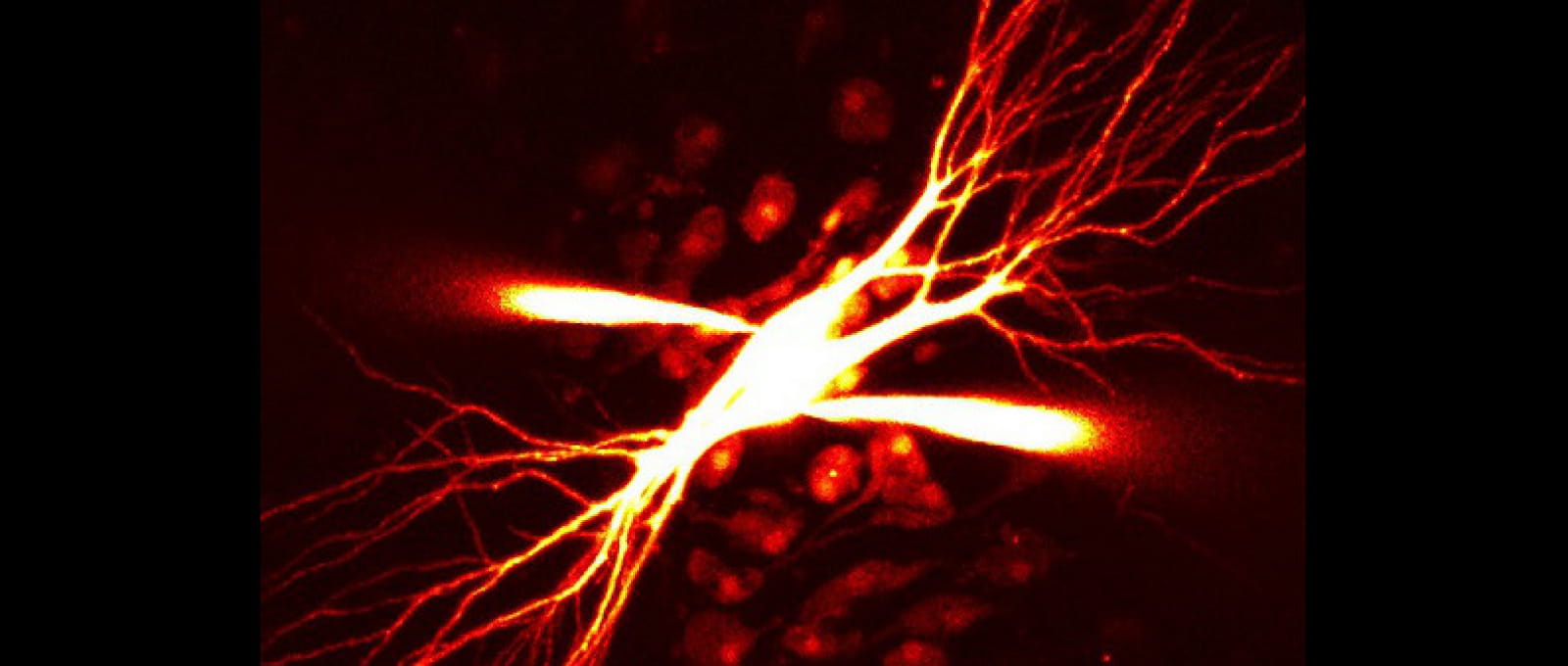
Unité de Neurobiologie des canaux Ioniques et de la Synapse

L’Unité de Neurobiologie des canaux Ioniques et de la Synapse ou UNIS (INSERM – Aix-Marseille Université UMR 1072) étudie le rôle des canaux ioniques dans la communication neuronale, la plasticité et les maladies du cerveau.
L’axe 1 (responsable : D. Debanne) étudie la physiologie neuronale des petits circuits de neurones. Quatre thèmes sont abordés: 1) Mécanismes d’induction et d’expression de la plasticité de l’excitabilité neuronale, 2) Rôle des canaux ioniques axonaux dans la transmission synaptique, 3) Plasticité de la transmission synaptique à long terme et 4) Transmission synaptique dans le cervelet.
L’axe 2 (Responsable : O El Far) étudie les mécanismes moléculaires de la transmission synaptique et de l’excitabilité neuronale. Trois thèmes sont abordés : 1) Implication des sous-unités du secteur V0 de la V-ATPase dans la transmission synaptique, 2) Contrôle de l’excitabilité neuronale par la protéine LGI1 et 3) Activité et récepteurs des neurotoxines botuliques.
L’axe 3 (responsable : J.M. Goaillard) étudie les mécanismes cellulaire et moléculaires de la robustesse de la décharge des neurones de la substance noire.
Le laboratoire UNIS en images



Les équipes de recherche
L’activité des équipes de recherche est centrée sur le rôle des canaux ioniques dans la communication neuronale, la plasticité et les maladies du cerveau.
Plasticité de l’excitabilité neuronale et épilepsie
DescriptionNous avons établi que les règles de plasticité de la transmission synaptique sont également valides pour la plasticité de l’intégration synaptique dans les cellules pyramidales et les interneurones de l’hippocampe. Nous avons démontré que les interneurones sont aussi le siège de régulation de l’excitabilité impliquant les canaux Kv1. Nous explorons à l’heure actuelle les mécanismes de régulation homéostatique des canaux Kv1, la nature des changements intrinsèques associés à la dépression à long-terme de la transmission synaptique et le rôle de la plasticité intrinsèque dans l’amblyopie.
Par ailleurs, nous étudions les facteurs qui déterminent la synchronisation neuronale au niveau de deux sites stratégiques: la synapse et le segment initial de l’axone. Nous avons montré que le délai synaptique dépend de la probabilité de libération et de la forme du potentiel d’action présynaptique. Nous avons identifié l’importance du potentiel précédant le potentiel d’action dans la précision de la décharge neuronale. Nous explorons également le rôle de l’activité synaptique inhibitrice dans la précision de la décharge neuronale.
Enfin, nous étudions le rôle des canaux sodiques et potassiques de l’axone dans la transmission de l’information neuronale. Nos projets visent à comprendre les mécanismes de régulation analogue-digitale de la transmission synaptique.
DEBANNE Dominique Total : 3 HDRs.
- Biologie moléculaire
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Imagerie calcique
- Electrophysiologie (sur tranches ou cellules)
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Modélisation
- Immunomarquages, histologie, cytométrie en flux
- Comportement animal
- Optogénétique
- la plasticité de l'excitabilité neuronale
- les déterminants du temps neuronal
- la fonction axonale
- Transmission synaptique dans le cervelet
Plasticité synaptique, segment initial, plasticité intrinsèque, temps, transmission synaptique, canaux ioniques, hippocampe, cortex, amblyopie
- Excitabilité, transmission synaptique, fonctions des réseaux
- Neurosciences computationnelles
- Pathologies du système nerveux
- Systèmes sensoriels
Mécanismes moléculaires de la libération de neurotransmetteurs
DescriptionNos intérêts portent sur 3 axes thématiques distincts :
- Nous nous intéressons particulièrement à l’implication des sous unités « V0c » et « V0d » de V-ATPase dans la libération de neurotransmetteurs.
- Nous nous intéressons aux effets de la protéine LGI1 (Leucin-Rich Glioma Inactivated 1) et de ses auto-anticorps sur la régulation de l’expression des canaux Kv1 et des conséquences sur l’excitabilité neuronale et la transmission synaptique.
- Au travers d’approches de biologie cellulaire, de biochimie et de modélisation, nous nous intéressons à la compréhension des mécanismes moléculaires qui régissent la reconnaissance des neurotoxines botuliques pour leurs récepteurs neuronaux.
EL FAR Oussama Total : 4 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Pharmacologie
- Implication des sous-unités du secteur V0 de la V-ATPase dans la modulation de transmission synaptique
- Contrôle de l’excitabilité neuronale par la protéine LGI1 (Leucine-rich Glioma-Inactivated 1)
- Activité et Récepteurs des Neurotoxines Botuliques
Synapse, fusion membranaire, exocytose, vésicules synaptiques, libération de neurotransmetteurs, complexes protéiques, neurotoxines botuliques
- Développement de méthodes et technologies innovantes
- Excitabilité, transmission synaptique, fonctions des réseaux
Robustesse de l'excitabilité
DescriptionNotre équipe s’intéresse aux mécanismes moléculaires et cellulaires responsables de la robustesse de l’activité neuronale. De nombreuses études ont démontré que les neurones sont capables de maintenir un patron d’activité stable en dépit de nombreuses perturbations externes ou internes. Les expériences de manipulation pharmacologique ou de déprivation sensorielle ont démontré que les propriétés des synapses ou des canaux ioniques sont régulées de façon dynamique de façon à maintenir un niveau d’activité stable (pour revue voir Turrigiano, Cell, 2008).
D’autre part, un nombre croissant d’études a montré que les délétions de certains canaux ioniques n’altèrent l’activité neuronale que de façon mineure (voir par ex. Swensen & Bean, J. Neurosci. 2005), illustrant ainsi la capacité des neurones à compenser les perturbations internes que peuvent représenter les mutations survenant de façon aléatoire dans le génôme. De façon évidente, cette stabilité dépend de la régulation dynamique des différents canaux ioniques (activés par les neurotransmetteurs ou par le potentiel) responsables de l’activité neuronale
GOAILLARD Jean-Marc Total : 3 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Pharmacologie
- Bioinformatique
- Robustesse du pacemaking à la variabilité biophysique
- Cartographie transcriptome-phenotype
Plasticité homéostatique, robustesse, canaux ioniques, électrophysiologie, animaux transgéniques, transcriptomique sur cellule unique.
- Développement du système nerveux
- Excitabilité, transmission synaptique, fonctions des réseaux
- Neurosciences computationnelles
- Pathologies du système nerveux
- Systèmes moteurs


