Description de la soumission d'un avis
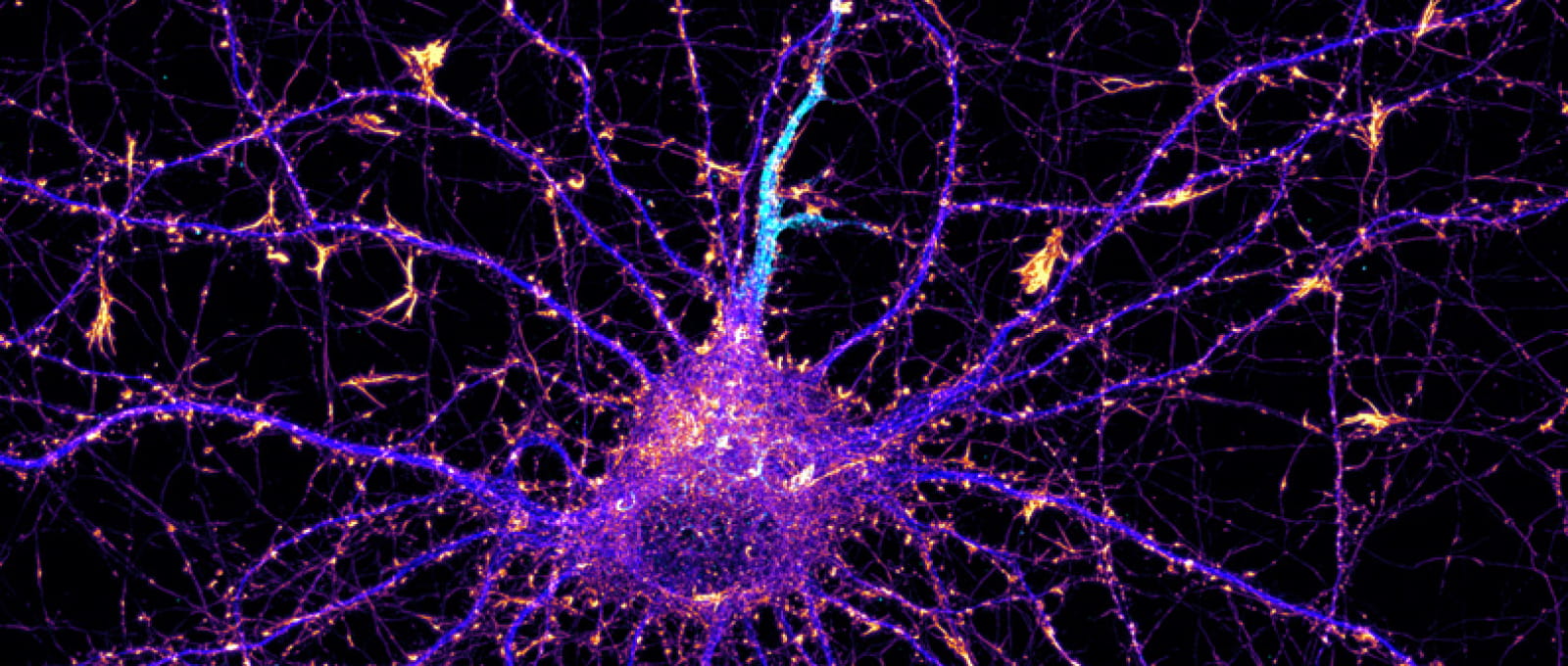
Institut de Neurophysiopathologie

- BHE et neuroinflammation
- Dégénénérescence et Plasticité Neurales
- NOSE. Nasal Olfactory Stemness and Epigenesis
- Gènes, rythme et neurophysiopathologie
- Neurobiologie des processus mnésiques
- Neuro-inflammation et sclérose en plaques
- Cellules souches, Modélisation pathologiques et Neurorégénération
- NeuroCyto : fonctions et dysfonctions du cytosquelette neuronal
- Gliomagénèse et MicroEnvironnement
- Cytosquelette et neurophysiopathologie
- Angiogénèse, invasivité et micro-environnement
- Vieillissement et pathologies du lignage oligodendroglial - INP
- Vect-Horus
L’Institut de NeuroPhysiopathologie (INP, UMR7051), dirigé par Michel Khrestchatisky, a été créé au 1er janvier 2018, sous la tutelle du CNRS et d’AMU et sera hébergé dans des locaux rénovés au sein de la Faculté de Médecine de Marseille. Cette opération s’inscrit dans le projet NeuroTimone visant à former un pôle d’excellence en Neurosciences. L’INP a pour particularité de conjuguer recherche publique et privée au sein d’un Laboratoire Commun de Recherche, notamment grâce au partenariat avec la société de biotechnologies VECT-HORUS spécialisée dans le ciblage cérébral d’agents thérapeutiques. Des plateformes technologiques (PFRN, PFNT) dans les domaines de l’imagerie, de l’étude des interactions moléculaires et des cellules souches (iPS) sont labellisées et adossées à l’INP, renforçant ainsi son potentiel de recherche. L’INP regroupe près de 150 personnes réparties en 11 équipes de recherche. Avec des compétences complémentaires sur modèles animaux et in vitro, les équipes du laboratoire étudient des mécanismes cellulaires et moléculaires qui régissent les bases neurales du fonctionnement et dysfonctionnement du cerveau. Plusieurs équipes ont pour objectifs de mieux comprendre la biologie des gliomes et d’identifier de nouvelles cibles thérapeutiques. D’autres s’intéressent à la plasticité neuronale et aux processus mnésiques, ainsi qu’aux processus neurodégénératifs et neuro-inflammatoires impliqués dans les troubles du développement, la maladie d’Alzheimer, la sclérose en plaques et les traumatismes médullaires. Les équipes valorisent leur recherche avec : i) des approches de thérapie moléculaire, avec des agents qui contrôlent l’action des protéases matricielles, la neuro-inflammation, le recrutement leucocytaire, la régénération axonale, la progression tumorale; ii) des approches de thérapie cellulaire dans le système nerveux central, avec des cellules souches de la muqueuse olfactive nasale et des cellules neurales dérivées de cellules pluripotentes induites (cellules iPS); iii) des stratégies innovantes de vectorisation pour l’adressage de médicaments ou d’agents d’imagerie au système nerveux central à travers la barrière hémato-encéphalique.
Le laboratoire INP en images



Les équipes de recherche
Les 11 équipes de l’INP étudient à un niveau fondamental, à travers des modèles animaux et cellulaires, à différents niveaux d’intégration et dans divers contextes pathologiques, les interactions entre les cellules neuronales, gliales, endothéliales et immunitaires, et leurs rôles dans la plasticité des réseaux de neurones, dans les horloges biologiques et dans la fonction cognitive. Les équipes de l’Institut étudient, au cours du développement et du vieillissement différentes maladies, dont la maladie d’Alzheimer, la sclérose en plaques, les processus neuro-inflammatoires et neurodégénératifs, le glioblastome, la tumorigenèse, l’angiogenèse et des altérations de la barrière hémato-encéphalique (BHE).
BHE et neuroinflammation
DescriptionLe système nerveux central (SNC) jour un rôle majeur dans le fonctionnement de l’organisme et bénéficie de ce fait d’un système vasculaire particulièrement adaptée à sa protection, la barrière hémato-encéphalique (BHE). Elle protège efficacement le SNC de l’entrée d’agents endogènes ou exogènes potentiellement neurotoxiques, mais limite considérablement le passage d’agents pharmacologiques, thérapeutiques ou d’imagerie. La BHE apparaît ainsi comme une entrave majeure au traitement des pathologies du SNC alors que la prévalence des pathologies du SNC augmente et que l’aire thérapeutique du SNC est l’un des principaux marchés pharmaceutiques. Les mécanismes moléculaires et cellulaires qui régulent la fragilisation et la perméabilité de la BHE dans un contexte neuro-inflammatoire restent encore mal connus et sont au centre de nos projets. Par ailleurs, nous nous intéressons à des familles de récepteurs impliqués dans des processus de transport à travers la BHE et nous développons des molécules vecteurs qui se lient de manière spécifique à ces récepteurs afin de favoriser le transport d’agents thérapeutiques et d’imagerie à travers cette barrière. Ces projets sont réalisés en partenariat avec la société Vect-Horus, spin off du laboratoire.
Michel Khrestchatisky Total : 3 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Comportement animal
- Imagerie cérébrale – Animal
- Analyse de données médicales
- Bioinformatique
- Neuromodulation de la perméabilité de la BHE
- Vectorisation de molécules à travers la BHE.
Barrière hémato-encéphalique, neuro-inflammation, cellules endothéliales, analyses transcriptionnelles, protéomiques, agents thérapeutiques, agents d’imagerie, vectorisation, Alzheimer, glioblastome.
- Cognition et comportement des animaux
- Développement de méthodes et technologies innovantes
- Pathologies du système nerveux
Dégénénérescence et Plasticité Neurales
DescriptionComprendre et combattre la maladie d’Alzheimer est un défi primordial en neuroscience. La maladie d’Alzheimer est le trouble neurodégénératif le plus dévastateur, avec un fardeau socio-économique majeur. Malgré les efforts investis, la découverte d’un remède ne semble pas être à portée de main à ce stade. Il est donc urgent d’identifier de nouvelles cibles dans le déclenchement/progression de la maladie et les mécanismes moléculaires sous-jacents.
Nous cherchons à comprendre le rôle de certaines voies protéolytiques à la croisée de trois processus pathogènes fondamentaux: la neuroinflammation, l’amyloïdogenèse et les dysfonctionnements synaptiques. Nos découvertes originales placent les métalloprotéases matricielles liées à la membrane (MT-MMPs) comme de nouveaux acteurs et de nouvelles cibles thérapeutiques potentielles dans la pathogenèse d’Alzheimer car elles favorisent la neuroinflammation et l’amyloïdogenèse, et altèrent la transmission synaptique.
Nous avons deux objectifs principaux: i) améliorer notre compréhension des mécanismes physiopathologiques de la maladie d’Alzheimer, et ii) développer et valider des stratégies thérapeutiques innovantes sur la base de cibles nouvellement découvertes. Nous utilisons des techniques de pointe de biologie moléculaire et cellulaire, de biochimie, d’imagerie, de pharmacologie, d’électrophysiologie et de comportement animal, sur des modèles in vivo et in cellulo de la pathologie, en collaboration avec des équipes INP et internationales.
Santiago Rivera Total : 2 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Imagerie calcique
- Electrophysiologie (sur tranches ou cellules)
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Comportement animal
- Analyse de données médicales
- Bioinformatique
- Maladie d'Alzheimer
- Mécanismes physiopathologiques et stratégies thérapeutiques innovantes
Maladie d’Alzheimer, neurodégénérescence, neuroinflammation, protéolyse, métalloprotéases, nouvelles cibles thérapeutiques, cellules iPS, Crispr/Cas9, souris transgéniques, whole cell patch clamp.
- Cognition et comportement des animaux
- Développement de méthodes et technologies innovantes
- Excitabilité, transmission synaptique, fonctions des réseaux
- Pathologies du système nerveux
NOSE. Nasal Olfactory Stemness and Epigenesis
DescriptionNotre équipe a co-découvert et caractérisé les cellules souches olfactives de la cavité nasale. Nous utilisons ces cellules pour étudier les mécanismes moléculaires qui sous-tendent les troubles du spectre autistique. Une expression anormale d’une enzyme (MOCOS) a été mise en évidence. Nous évaluons désormais le rôle de cette enzyme au cours du développement cérébral et tentons d’identifier des médicaments qui restaurent l’expression de MOCOS. L’équipe utilise également des cellules souches olfactives humaines pour réparer le corps. Nous avons transplanté ces cellules dans des modèles d’amnésie et de la maladie d’Alzheimer (MA). Nous concevons actuellement de nouveaux protocoles pour la différenciation des cellules souches en neurones dopaminergiques. Par ailleurs, des essais cliniques ciblant la réparation nerveuse et osseuse sont en préparation. En parallèle, afin d’améliorer la récupération fonctionnelle, l’équipe évalue les rôles immuno-modulateurs et neurotrophiques de la vitamine D. Nos études précliniques sur des modèles de paraplégie et de MA sont très encourageantes.
François Féron Total : 5 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Imagerie calcique
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Comportement animal
- Imagerie cérébrale – Animal
- Analyse de données médicales
- Bioinformatique
- Cellules souches olfactives, outil diagnostique.
- Cellules souches olfactives, outils de thérapie cellulaire.
- Vitamine D, hormone neurostéroide
Cellules souches, plasticité, thérapie cellulaire, vitamine D, autisme, maladie de Parkinson, maladie d’Alzheimer, rythmes circadiens, ARN non codants, syndrome de Prader-Willi, récepteurs olfactifs
- Cognition et comportement des animaux
- Cognition et comportement humains
- Développement du système nerveux
- Excitabilité, transmission synaptique, fonctions des réseaux
- Pathologies du système nerveux
- Systèmes sensoriels
Gènes, rythme et neurophysiopathologie
DescriptionL’alternance quotidienne du jour et de la nuit due à la rotation de la Terre le long de son axe, a conduit tous les organismes vivants sur cette planète à développer des chronomètres internes appelés horloges circadiennes qui leur permettent de s’adapter et d’anticiper ce changement quotidien de l’environnement.
Les recherches de l'équipe se concentrent sur les mécanismes moléculaires de ces horloges circadiennes, en particulier celles impliquant de longs ARN non codants.
Sachant que des altérations profondes de notre horloge biologique peuvent être observées chez des patients atteints de pathologies du système nerveux central, l'équipe a également pour mission d'étudier le rôle joué par les gènes, les protéines et les longs ARN non codants impliqués dans le fonctionnement de l’horloge circadienne, dans les maladies cérébrales, en particulier les maladies neuro-développementales telles que le syndrome de Prader-Willi.
Anne-Marie François-Bellan Total : 2 HDRs
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, Hybridation in situ
- Microscopie
- Pharmacologie
- Comportement animal
- Analyse de données NGS
- Bioinformatique
- Caractérisation des mécanismes moléculaires impliqués dans le contrôle de l'expression circadienne de gènes, en particulier ceux impliquant des ARNnc tels que Neat1 ou Malat1
- Caractérisation des anomalies circadiennes associées à la physiopathologie du syndrome de Prader-Willi et identification des gènes impliqués dans ces dysfonctionnements
Rythmes circadiens, expression génique, régulation post-transcriptionnelle, ARN non codants, paraspeckles, syndrome de Prader-Willi, analyses bioinformatiques NGS
- Cognition et comportement humains
- Développement du système nerveux
- Excitabilité, transmission synaptique, fonctions des réseaux
- Pathologies du système nerveux
- Systèmes sensoriels
Neurobiologie des processus mnésiques
DescriptionL’équipe travaille sur les modifications du substrat neurobiologique au cours des processus d’apprentissage et de mémorisation, y compris dans des conditions pathologiques. L’hypothèse sous-jacente est que l’élaboration des traces mnésiques durables repose sur le marquage de réseaux neuronaux spécifiques. Ces mécanismes de plasticité synaptique résultent de modifications moléculaires et de changements structuraux qui restent, pour une grande part, à identifier et à intégrer au niveau comportemental.
Chez la souris, nous avons développé une nouvelle épreuve olfactive, « le labyrinthe olfactif tubulaire », où nous testons l’effet de molécules ou de manipulations génétiques sur les différentes sous-catégories de mémoire. Nous avons observé des modifications structurales spécifiques de la densité dendritique dorsale et apicale des cellules pyramidales du champ CA1 de l’hippocampe, spécifiquement amplifiées par un agoniste des récepteurs 5-HT4 connu pour son effet promnésiant. Actuellement, nous utilisons cette épreuve dans un modèle de la maladie d’Alzheimer (souris transgéniques 5XFAD).
Toujours avec pour objectif de créer des modèles animaux pour étudier la mémoire, nous avons développé un paradigme de tâches différées chez la souris qui met en évidence des déficits spécifiques tels qu’ils sont observés chez des patients atteints d’un syndrome frontal, avec notamment un comportement de persévération.
Enfin, dans l’optique de pallier des déficits mnésiques dans nos modèles de syndrome amnésique chez la souris, une nouvelle approche a consisté à effectuer des greffes intra-hippocampiques de cellules souches adultes de la muqueuse olfactive humaine. Suite à ces greffes, nous avons observé une récupération des capacités mnésiques et la capacité de ces cellules à acquérir un phénotype neural ou glial. Nous réalisons actuellement des greffes autologues chez des rats dans des modèles d’amnésie et de traumatismes médullaires.
François Roman Total : 3 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Electrophysiologie (in vivo)
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Comportement animal
- Tests psychophysiques
- Imagerie cérébrale – Animal
- Effet d’un agoniste des récepteurs 5-HT4 sur la structure des dendrites des neurones hippocampique
- Performances mnésiques d’un modèle de la maladie d’Alzheimer (souris transgéniques 5XFAD) dans un labyrinthe olfactif tubulaire
- Test de tâches différées chez un modèle souris de syndrome frontal
- Greffes autologues de cellules souches adultes chez des rats modèles d’amnésie ou de traumatismes médullaires.
Plasticité synaptique, apprentissage, mémoire, récepteurs 5HT4, pathologies mnésiques, greffes, cellules souches olfactives, maladie d’Alzheimer, troubles frontaux, traumatismes médullaires
- Cognition et comportement des animaux
- Cognition et comportement humains
- Excitabilité, transmission synaptique, fonctions des réseaux
- Pathologies du système nerveux
- Systèmes sensoriels
Neuro-inflammation et sclérose en plaques
DescriptionL’équipe » Neuroinflammation et sclérose en plaques » est une équipe de recherche émergente issue de l’équipe » BHE et Neuroinflammation « . Elle est coordonné par Sophie Desplat-Jégo, MCU-PH, MD, PhD, spécialisée en immunologie médicale. L’équipe a développé un sujet de recherche sur le rôle de la cytokine TWEAK, membre de la famille TNF pendant la neuroinflammation, en particulier dans le contexte pathologique de la sclérose en plaques et son groupe a généré des articles de référence qui décrivent les effets délétères de TWEAK dans le système nerveux central pendant la sclérose en plaques et son modèle animal, EAE. Au cours des dernières années, le projet TWEAK s’est concentré sur l’étude des effets biologiques de TWEAK sur les propriétés de la BHE. Dans les années à venir, l’équipe poursuivra ses études sur la neuroinflammation et l’implication de TWEAK dans la sclérose en plaques.
- Évaluer la pertinence de cibler la voie TWEAK/Fn14 dans le SNC pour le traitement de la sclérose en plaques.
- Caractériser les conséquences biologiques de la régulation à la hausse de la production d'anticorps solubles TWEAK et TWEAK pendant la production d'EAE /MS.
- Déterminer si TWEAK est sujet au polymorphisme et déterminer les conséquences fonctionnelles de ce polymorphisme.
- Pathologies du système nerveux
Cellules souches, Modélisation pathologiques et Neurorégénération
DescriptionNotre équipe étudie les mécanismes moléculaires et cellulaires responsables des processus pathogènes dans le cerveau, se concentrant sur deux maladies pour lesquelles l’absence de traitements efficaces appelle à un besoin de nouvelles connaissances: 1) la maladie d’Alzheimer (MA); et 2) les tumeurs cérébrales (gliomes).
Apporter des réponses aux questions que l’on se pose est le fondement même de la Science. Ainsi, notre équipe s’interroge sur: Comment certains facteurs de risque génétiquesinfluent sur la pathogenèse de la MA? La neuroinflammation est-elle un évènement critique dans la pathogenèse de la MA? L’astrocyte est-il un déterminant cellulaire central dans la MA? Nous travaillons également sur la validation de nouvelles cibles thérapeutiques dans la MA. Par ailleurs, nous développons des modèles cellulaires humains visant à récapituler les processus gliomagéniques, permettant l’étude des mécanismes sous-jacents et offrant la possibilité de cribler/tester des molécules contre les cellules cancéreuses.
Notre recherche repose sur le développement / l’utilisation de stratégies innovantes de modélisation de maladies basées sur la reprogrammation cellulaire (en particulier les cellules souches pluripotentes induites) ainsi que sur les technologies d’édition du génome (CRISPR-Cas9). Nous combinons ce socle expérimental avec une batterie de techniques (biologie moléculaire/cellulaire, biochimie, imagerie, pharmacologie) pour répondre à nos questions.
Emmanuel Nivet Total : 1 HDR
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Imagerie calcique
- Electrophysiologie
- Pharmacologie
- maladie d'Alzheimer
- gliomagénése
- reprogrammation cellulaire
Maladie d'Alzheimer, gliome, reprogrammation cellulaire, neuroinflammation, CRISPR-Cas9, facteurs de risque génétiques.
- Développement de méthodes et technologies innovantes
- Pathologies du système nerveux
NeuroCyto : fonctions et dysfonctions du cytosquelette neuronal
Description« NeuroCyto : fonctions et dysfonctions du cytosquelette neuronal » est une jeune équipe ATIP qui fait partie de l’Institut de NeuroPhysiopathologie (INP, CNRS-Aix Marseille Université UMR 7051), laboratoire de la Faculté de Médecine d’Aix-Marseille.
L’équipe comporte actuellement six personnes, et nous accueillons des étudiants tout au long de l’année. N’hésitez pas à nous contacter si vous êtes intéressé ! Nous cherchons à réunir une équipe dynamique pour faire la meilleure science possible en cultivant l’ouverture, l’échange, et l’enthousiasme pour les découvertes petites ou grandes.
Nous nous intéressons à la façon dont les neurones s’organisent en tant que cellules : comment font-ils pour se différencier, puis développer et maintenir leur arborisation complexe ? Comment maintiennent-ils leur polarité, avec un axone et des dendrites qui permettent d’envoyer et de recevoir l’information ? La construction de l’architecture cellulaire (grâce au cytosquelette), les mécanismes du transport des protéines (moteurs, diffusion), la compartimentation en éléments distincts (axone, synapses, épines dendritiques…) : de nombreux phénomènes encore largement mystérieux contribuent à cette organisation. Pour mieux les comprendre, l’équipe NeuroCyto applique de nouvelles méthodes de microscopie, notamment la microscopie de super-résolution qui permet d’aller observer les assemblages moléculaires à l’échelle nanométrique directement dans les cellules pour mieux comprendre le fonctionnement neuronal.
Christophe Leterrier Total : 1 HDR.
- Biologie moléculaire (PCR...)
- Biochimie (Western blot...)
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie (à fluorescence, confocale, électronique...)
- Biologie cellulaire du neurone
- Cytosquelette axonal
- Microscopie de super-résolution
Cytosquelette neuronal, axonal, microscopie super-résolution, organisation des neurones.
- Développement de méthodes et technologies innovantes
- Développement du système nerveux
- Excitabilité, transmission synaptique, fonctions des réseaux
Gliomagénèse et MicroEnvironnement
DescriptionNotre équipe GlioME a pour objectif de mieux comprendre la biologie des gliomes humains, d’identifier de nouvelles cibles thérapeutiques et d’évaluer le potentiel de nouvelles thérapies anticancéreuses en utilisant des modèles précliniques cellulaires et murins appropriés. Les gliomes sont les tumeurs intracrâniennes les plus courantes chez l’homme. La forme la plus maligne est le glioblastome (GBM, grade IV), avec une incidence de 3-5/100 000 personnes dans les pays occidentaux. Malgré une résection chirurgicale optimale suivie d’une chimiothérapie et d’une radiothérapie, la survie médiane des patients porteurs d’un GB reste dramatique : 12-15 mois. Notre équipe s’attache donc à étudier l’origine des cellules de gliomes ainsi que le microenvironnement complexe de ces tumeurs afin d’envisager le développement de nouvelles stratégies thérapeutiques.
Nos objectifs sont:
- Identifier de nouvelles cibles thérapeutiques et développer les modèles précliniques appropriés
- Identifier des biomarqueurs spécifiques et participer à des essais cliniques
Notre équipe est également impliquée dans des consortiums fondamentaux dédiés à la conception et au développement de nanoparticules pour le traitement des gliomes.
FIGARELLA-BRANGER Dominique Total : 7 HDRs.
- Biologie moléculaire
- Biochimie
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Chirurgie animale, stéréotaxie
- Pharmacologie
- Imagerie cérébrale – Animal
- Analyse de données médicales
- Bioinformatique
Fondamentaux
- Etude du rôle de l’épitope A2B5, marqueur de cellules souches cancéreuses, dans la gliomagénèse
- Rôle des inhibiteurs de l’apoptose (IAP) dans la croissance des glioblastomes et en particulier dans la maintenance des propriétés souches des cellules tumorales, et le microenvironnement (angiogénèse, hypoxie et réponse inflammatoire)
- Rôle du cytosquelette microtubulaire et des protéines régulant cette dynamique (ex : famille EB) dans la croissance des glioblastomes (maintenance des propriétés souches et microenvironnement tumoral)
Translationnels : Biomarqueurs / Thérapie
- Mise en évidence de marqueurs diagnostiques, pronostiques et prédictifs de réponse aux traitements dans les gliomes et les tumeurs glioneuronales
- Marqueurs circulants prédictifs de réponse aux traitements : exemple des MMP
- Etude pharmacologique de nanoparticules inorganique à visée théranostique
Gliomes humains, microenvironnement, cellules souches, A2B5, IAPs, dynamique des microtubules, nanoparticules, marqueurs diagnostiques, pronostiques et prédictifs de réponse au traitement, cibles thérapeutiques, modèles précliniques.
- Développement de méthodes et technologies innovantes
- Pathologies du système nerveux
Cytosquelette et neurophysiopathologie
DescriptionNous cherchons à identifier des biomarqueurs et de nouveaux composés pharmacologiques actifs pour le cancer et les maladies neurodégénératives, en mettant l’accent sur le cytosquelette de tubuline et la protéine Tau, les Rho-GTPases, les intégrines et la signalisation redox.
KOVACIC Hervé, PEYROT Vincent Total : 5 HDRs.
- Biologie moléculaire
- Biochimie
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie
- Pharmacologie
- Bioinformatique
- Biophysique des interactions moléculaires
- Modifications post-traductionnelles de Tau: de la molécule au patient
- Nouveaux biomarqueurs avec des potentiels thérapeutiques en neurologie et neuro-oncologie
- NADPH oxydase et neurotoxicité
Microtubules, actine, Tau, protéinopathies, NAPDH oxydases, glioblastomes, résistance aux chimiothérapies, nouveaux agents thérapeutiques.
- Développement de méthodes et technologies innovantes
- Pathologies du système nerveux
Angiogénèse, invasivité et micro-environnement
DescriptionLe glioblastome (GBM) est une tumeur cérébrale dévastatrice caractérisée par une invasion locale, une prolifération microvasculaire et une résistance thérapeutique. La nature hautement infiltrante des cellules de gliome rend peu probable une résection chirurgicale complète, et 90 % des tumeurs réapparaissent. Les gliomes de haut grade sont parmi les plus angiogéniques de toutes les tumeurs. L’adrénomédulline (AM) est un peptide amino-acide C-terminal amidé de 52 acides aminés, largement exprimé dans divers types de tumeurs et s’est révélé mitogène pour de nombreuses lignées cellulaires cancéreuses humaines in vitro.
L’AM se lie à son activité et en assure la médiation par l’intermédiaire du récepteur couplé à la protéine G, le récepteur de type récepteur de la calcitonine (CLR), la spécificité de l’AM étant conférée par l’activité du récepteur modifiant les protéines -2 (RAMP2) et -3 (RAMP3). L’ablation génétique d’AdM, calcrl, Ramp2 ou de l’enzyme responsable de l’amidation AM fonctionnelle, peptidylglycine α-amidating monooxygénase (PAM) entraîne une létalité midgestational associée à un œdème interstitiel sévère et à des défauts cardiovasculaires. Les études in vivo soulignent l’importance de l’AM comme facteur important pour favoriser la croissance tumorale et affecter le microenvironnement tumoral en induisant l’angiogenèse pathologique et la lymphangiogenèse. Des études d’accumulation suggèrent un nouveau rôle pour l’AM en tant que molécule de diaphonie croisée qui intègre les cellules stroma tumorales et microenvironnementales sous-jacentes aux mécanismes de promotion pour faciliter l’angiogenèse et la croissance tumorale.
Plusieurs études in vivo ont montré une régression des néovessels tumoraux et de la croissance lors du traitement avec des anticorps neutralisants AM, un antagoniste des récepteurs AM ou une interférence des récepteurs AM. Ces résultats mettent en évidence l’implication de la MA dans la progression de la croissance tumorale et de l’angiogenèse, suggérant que le ciblage du système AM peut être une stratégie thérapeutique utile dans le cancer du cerveau.
Par conséquent, la compréhension des mécanismes moléculaires par lesquels la GA peut déterminer l’intégrité des néovessels tumoraux sera l’objectif principal de notre recherche avec l’utilisation de la GBM comme modèle pour poursuivre nos projets
- Rôle de la MA dans le recrutement de cellules dérivées de la moelle osseuse pro-vasculaire et pro-angiogénique dans la néovascularisation tumorale.
- Rôle et mécanismes d'action de la MA dans la stabilisation des vaisseaux sanguins tumoraux dans la GBM
- Rôle de la MA dans la néoangiogenèse et/ou la vasculogenèse pendant la récidive du gliome après radiothérapie. Expression du système MA dans les cellules vasculaires associées aux glioblastomes.
- Problèmes thérapeutiques : inhibition de la croissance tumorale du glioblastome en ciblant uniquement le système MA à l'aide d'anticorps monoclonaux ou en combinaison avec des médicaments classiques ou innovants.
Vieillissement et pathologies du lignage oligodendroglial - INP
DescriptionDans le système nerveux central, les cellules oligodendrogliales représentent une abondante population cellulaire aux fonctions essentielles, fournissant isolation physique et apport trophique aux neurones. Des cellules progénitrices des oligodendrocytes aux oligodendrocytes myélinisants, cette lignée gliale est donc cruciale pour les fonctions cérébrales, telles que l'apprentissage et la mémoire. Malheureusement, les capacités oligodendrogliales diminuent avec l'âge, ce qui coïncide avec un profond déclin des capacités cognitives. Une myélinisation défectueuse a été attribuée à des changements épigénomiques, transcriptomiques et phénotypiques liés à l'âge dans la lignée oligodendrogliale, affectant leurs propriétés.
Notre équipe s'intéresse aux questions suivantes : Comment le vieillissement affecte-t-il les cellules oligodendrogliales ? Quel impact sur la plasticité cognition avec l’âge et dans les maladies neurodégénératives ? Peut-on rajeunir les cellules oligodendrogliales ?
En testant le comportement de modèles murins « aging-like » et de maladies, nous étudions le rôle des cellules oligodendrogliales dans le vieillissement, les maladies psychiatriques et neurodégénératives. Nous utilisons des approches transcriptomiques et des tests in vitro pour identifier et caractériser les mécanismes moléculaires qui régulent l'interaction neuro-oligodendrogliale. Nous exploitons également des activateurs épigénétiques non invasifs pour réactiver ces cellules dans nos modèles de vieillissement et de maladies.
Moyon Sarah
- Biologie moléculaire (PCR...)
- Biochimie (Western blot...)
- Culture cellulaire
- Immunomarquages, histologie, cytométrie en flux
- Microscopie (à fluorescence, confocale, électronique...)
- Chirurgie animale, stéréotaxie
- Comportement animal
- Imagerie cérébrale – Animal
- Optogénétique
- Bioinformatique
1. Vieillissement des cellules oligodendrogliales et cognition
2. Rôle des cellules oligodendrogliales dans les maladies neurodégénératives (maladie d’Alzheimer’s)
3. Communication entre les cellules neuronales et oligodendrogliales
4. Approches épigénétiques pour rajeunir le cerveau
Oligodendrocytes, Myélinisation, Communication Neuronale-oligodendrogliale, Vieillissement, Cognition, Neurodégénérescence, Maladie d’Alzheimer’s, Épigénétique, Activation médiée par TET1
- Cognition et comportement des animaux
- Développement de méthodes et technologies innovantes
- Pathologies du système nerveux
Vect-Horus
DescriptionVECT-HORUS est une société de biotechnologie qui conçoit et développe des vecteurs à base de peptides qui facilitent l’administration de médicaments ou d’agents d’imagerie dans les organes, notamment dans le cerveau, et dans les tumeurs. Les vecteurs ciblent les récepteurs impliqués dans le « Receptor Mediated Transport » (RMT, un système physiologique pour le transport dans les cellules de substances endogènes). En combinant des médicaments ou des agents d’imagerie à ces vecteurs, VECT-HORUS leur permet de franchir des barrières biologiques qui limitent l’accès à leur cible, notamment la barrière hémato-encéphalique (BHE).
Pour en savoir plus, consultez leur site internet.


